pH
O pH de uma amostra de água é a medida da concentração de íons Hidrogênio. O pH da água determina a solubilidade (quantidade que pode ser dissolvida na água) e a disponibilidade biológica (quantidade que pode ser usada pela biota aquática) dos constituintes químicos, tais como os nutrientes (P, N e C) e metais pesados (Pb, Cu, Cd e outros). A figura abaixo mostra a Escala do pH.
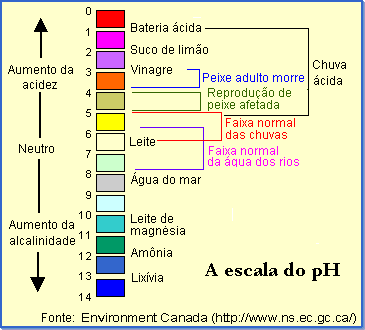
Lagos ácidos tendem a ter águas claras, porque contêm pouca ou nenhuma alga. Também podem não conter peixes. Uma ligeira acidificação da água aumenta a solubilização dos fosfatos, fazendo com que maiores quantidades de fósforo solúvel passem à água em menos tempo.
A Tabela abaixo mostra a influência do pH para a fauna aquática:
| pH | SIGNIFICADO |
|---|---|
| >=8,5 | Sob fotossíntese vigorosa |
| 6,5 a 8,5 | Normal |
| 6 a 7 | Levemente ácido |
| 5,6 | Água da chuva (referência) |
| 5,5 a 6 | Sob perigo |
| 5 a 5,4 | Estado crítico |
| <5,4 | Acidificado |
As consequências do pH para a fauna/flora aquática também podem ser resumidas
(segundo o
Wupcenter), como abaixo:
- Bactérias: 1,5 a 13,5
- Plantas: 6,5 a 12,0
- Peixes: 6,0 a 9,0 (carpa, bagre e sugadores)
- Moluscos: 7,5 a 9,0 (caramujos, ostras e mexilhões)
- Invertebrados aquáticos: 6,5 a 7,5